医学总监
(1人)

10-20K元/月

{bc_title1}
{bc_date}
{bc_job_count}个职位
{live_item_title}
{live_item_date}
{state_str}
保障福利
- 高薪职位
- 每周双休
- 公积金
- 年假
- 年终奖
- 工作餐
- 公费培训
- 标准工时
- 优质企业
- 社会保险
- 加班费
职位详情
【工作内容】
- 根据公司生物制品管线规划,制定临床研究的总体策略,包括确定各阶段研究目标、研究人群、研究设计类型等,确保临床研究符合法规要求并能有效支持产品的注册和市场推广。与研发部门紧密合作,参与评估生物制品的临床前研究结果,为临床研究的启动提供科学依据。
- 负责领导和管理公司生物制品的临床研究项目,包括项目计划制定、预算编制与控制、资源分配、项目进度跟踪等,确保项目按时、按质、按量完成。监督临床研究机构(CRO、医院等)的筛选、评估和管理工作,确保合作方具备良好的研究能力和质量控制体系。对临床研究数据进行审核和分析,与统计学家合作进行数据解读,撰写和审核临床研究报告,为产品的注册申报提供关键的医学支持。熟悉生物治疗产品的生产、质量控制和应用,尤其是马源抗体(如F(ab')2)的相关经验。具备抗毒素的药代动力学、药效学及潜在毒性知识。
- 建立和完善临床研究中的安全性监测体系,负责对生物制品在临床试验过程中的安全性数据进行监测、评估和报告。及时识别和处理临床研究中的不良事件(AE)和严重不良事件(SAE),确保受试者的安全权益得到保护,并根据安全性数据对临床研究方案进行必要的调整。具备生物制品上市后安全监测与药物警戒经验,确保产品在长远使用中的安全性和有效性。对患者安全和抗毒素产品的伦理使用承担高度责任。
- 确保医学事务部的各项工作严格遵守国家和地方的法律法规、行业规范以及公司内部的规章制度,包括临床研究的伦理审查、药品注册法规、广告法等相关规定。精通全球和本地的监管框架,如FDA、EMA或CFDA有关生物制品的指南,特别是兽用和人用抗毒素的相关规定。具备临床试验过程的经验,能够设计和监督针对F(ab')2抗毒素的临床研究,确保产品的安全性和有效性。关注国内外生物制品领域法规政策的变化,及时调整部门工作流程和策略,为公司提供法规政策解读和应对建议。
- 负责医学事务部的团队建设和人员管理工作,包括招聘、培训、绩效考核、职业发展规划等,打造一支高素质、专业化的医学团队。激励团队成员发挥各自的专业优势,营造积极向上、团结协作的团队氛围,不断提升团队整体工作效率和创新能力。
- 与国内外生物制品领域的科研机构、学术团体、医疗机构等建立广泛的合作关系,开展学术交流、临床研究合作等项目,提升公司的行业影响力和技术创新能力。维护与政府部门、行业协会、专家学者等外部利益相关者的良好关系,积极参与行业会议、论坛等活动,为公司争取有利的政策支持和资源。
【任职要求】
- 医药学、生物制品相关专业(如临床医学、药学、生物学等)博士学位,具备医学博士(MD或同等学位);有医学执业资格证和项目管理专业人士资格认证(PMP)者优先。
- 具有多年(一般至少 8 - 10 年)的生物制品行业或医药行业工作经验;至少有 3 - 5 年以上的医学事务管理或临床研究管理经验。
- 具备扎实的医学专业知识,熟悉临床医学研究方法、统计分析、药物安全性监测等内容;具有良好的英语读写能力,能够熟练阅读和撰写英文医学文献、研究报告等; 熟练掌握项目管理工具和办公软件(如Microsoft Project、Excel、PowerPoint等)。
- 具备领导能力、团队管理能力和组织协调能力,能够有效地激励和引导团队成员达成工作目标;具有较强的战略思维能力、分析判断能力和决策能力,能够从宏观和微观角度把握医学事务工作的发展方向;良好的沟通能力和人际交往能力,能够与公司内部不同部门、外部合作伙伴以及医学专家等进行有效的沟通和协作;具备良好的创新能力和学习能力,能够紧跟生物制品领域的前沿发展动态,不断创新工作方法和模式。
联系我时,请说是在鹰潭人力资源网上看到的,谢谢!
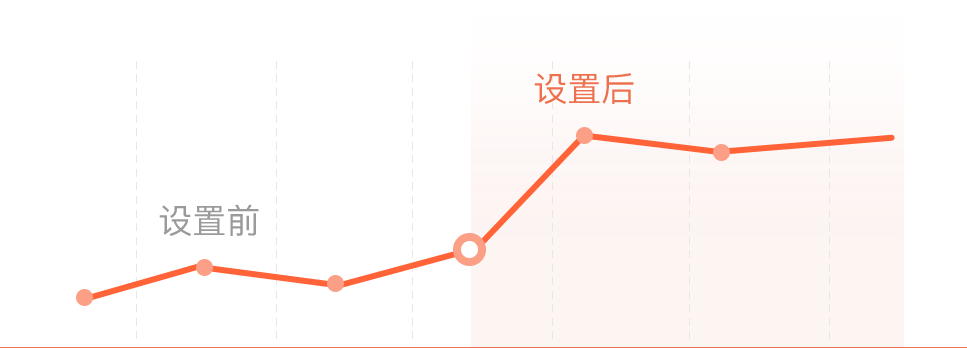
简历曝光率扩大 18 倍,HR主动邀约
企业信息
温馨提示
求职过程中,遇到企业收取费用、押金都可能有欺诈嫌疑,请警惕!
投递简历
×
完善简历提醒
你当前的在线简历填写不完整,现在投递求职成功率不高,
建议先完善后再投递,不能浪费任何一个机会哦~
×
扫码下载百城招聘个人版App
查看完整个人竞争力
简历已投递
但你的简历信息还不够完善,会影响您的求职效果哦~
建议您继续完善以下信息。
去完善
沟通成功!
已向该职位的HR发送消息
请在app内查看